El jueves hicimos la sintesis de algunos compuestos y luego hicimos su modelo fisico con plastico.
viernes, 15 de octubre de 2010
RECAPITULACION 5
El martes de esta semana hicimos la mezcla de HCl y Zn para separarlo , quedando en la botella H y O y al acercarle el fuego salio explotando y volo!


El jueves hicimos la sintesis de algunos compuestos y luego hicimos su modelo fisico con plastico.

El jueves hicimos la sintesis de algunos compuestos y luego hicimos su modelo fisico con plastico.
RECAPITULACION 4
La clase del martes hablamos acerca del porcentaje en volumen de la concentracion de las masas y mezclas, el profesor nos enseño como hacer estos calculos y despues hicimos ejercicios.
El jueves hicimos una practica de metodos de separacion quimicos en el cual se mezcla el agua con acido clorhidrico y despues la separamos por electrolisis.

El jueves hicimos una practica de metodos de separacion quimicos en el cual se mezcla el agua con acido clorhidrico y despues la separamos por electrolisis.
RECAPITULACION 3
El martes de la clase de quimica hicimos una actividad de mezclar agua con sal y marmol, para separarlas usamos primero el metodo de filtracion, posteriormente evaporamos el agua para que se separe de la sal.
El jueves de la clase de quimica mezclamos agua con tierra y lo separamos por el metodo de filtracion.

El jueves de la clase de quimica mezclamos agua con tierra y lo separamos por el metodo de filtracion.
INDAGACION BIBLIOGRAFICA. TIPOS DE MEZCLAS.
En química, una mezcla es un sistema material formado por dos o más sustancias puras no combinadas químicamente. En una mezcla no ocurre una reacción química y cada uno de sus componentes mantiene su identidad y propiedades químicas. No obstante, algunas mezclas pueden ser reactivas, es decir, que sus componentes pueden reaccionar entre sí en determinadas condiciones ambientales, como una mezcla aire-combustible en un motor de combustión interna.
MEZCLA HOMOGENEA.
MEZCLA HETEROGENEA
Una mezcla heterogénea es aquella que posee una composición no uniforme en la cual se pueden distinguir a simple vista sus componentes y está formada por dos o más sustancias, físicamente distintas, distribuidas en forma desigual. Las partes de una mezcla heterogénea pueden separarse mecánicamente. Por ejemplo, las ensaladas, o la sal mezclada con arena.

MEZCLA HOMOGENEA.
Una mezcla homogénea es aquella donde la sustancia pierde sus propiedades originales, se pueden separar por medios físicos. Su raíz «homo» indica semejante. A simple vista no se pueden ver sus componentes, en comparación de la heterogenea. Se conocen como disoluciones y están constituidas por un soluto y un solvente, siendo el primero el que se encuentra en menor proporción. Por ejemplo, el agua mezclada con sales minerales o con azúcar.
MEZCLA HETEROGENEA
Una mezcla heterogénea es aquella que posee una composición no uniforme en la cual se pueden distinguir a simple vista sus componentes y está formada por dos o más sustancias, físicamente distintas, distribuidas en forma desigual. Las partes de una mezcla heterogénea pueden separarse mecánicamente. Por ejemplo, las ensaladas, o la sal mezclada con arena.
INDAGACION BIBLIOGRAFICA. METODOS DE SEPARACION.
La correcta separación de mezclas nos ayuda a poner en práctica todos los métodos que se presentarán, para separar mezclas; es importante saber sobre su estadofísico , y características lo cual a continuación se presentará…
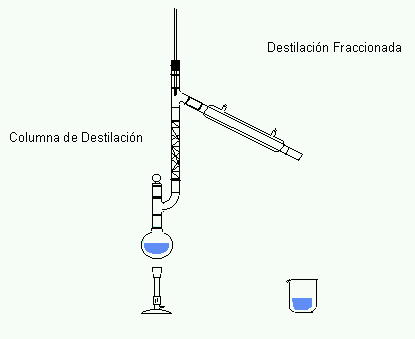
1) Destilación.
La destilación es el procedimiento más utilizado para la separación y purificación de líquidos, y es el que se utiliza siempre que se pretende separar un líquido de sus impurezas no volátiles.
Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interés en utilizar el componente evaporado. Los otros componentes quedan en el envase.
Un ejemplo de esto se encuentra en las Salinas. Allí se llenan enormes embalses con aguade mar , y los dejan por meses, hasta que se evapora el agua, quedando así un material sólido que contiene numerosas sales tales como cloruro de sólido, de potasio, etc…
Es un procedimiento que se utiliza cuando se quiere acelerar la sedimentación. Se coloca la mezcla dentro de una centrifuga, la cual tiene un movimiento de rotación constante y rápido, lográndose que las partículas de mayor densidad, se vayan al fondo y las más livianas queden en la parte superior.
Se utiliza una corriente de agua que arrastra los materiales más livianos a través de una mayor distancia, mientras que los más pesados se van depositando; de esta manera hay una separación de los componentes de acuerdo a lo pesado que sean.
Se fundamenta en la propiedadde algunos materiales de ser atraídos por un imán. El campo magnético del imán genera una fuente atractora, que si es suficientemente grande, logra que los materiales se acercan a él. Para poder usar este método es necesario que uno de los componentes sea atraído y el resto no.
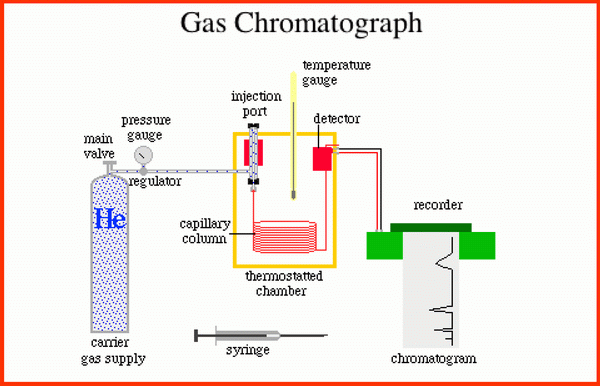
La cromatografía es una técnica cuya base se encuentra en diferentes grados de absorción, que a nivel superficial, se pueden dar entre diferentes especies químicas. En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
Consiste en separar materiales de distinta densidad. Su fundamento es que el material más denso

INDAGACION BIBLIOGRAFICA. CONTAMINACION Y PURIFICACION DEL AGUA.
El agua es uno de los recursos naturales fundamentales y es uno de los cuatro recursos básicos en que se apoya el desarrollo, junto con el aire, la tierra y la energía.
El agua es el compuesto químico más abundante del planeta y resulta indispensable para el desarrollo de la vida. Está formado por un átomo de oxígeno y dos de hidrógeno, y su fórmula química es H2O. En la naturaleza se encuentra en estado sólido, líquido o gaseoso.
La contaminación del agua es el grado de impurificación, que puede originar efectos adversos a la salud de un número representativo de personas durante períodos previsibles de tiempo.
Se considera que el agua está contaminada, cuando ya no puede utilizarse para el uso que se le iba a dar, en su estado natural o cuando se ven alteradas sus propiedades químicas, físicas, biológicas y/o su composición. En líneas generales, el agua está contaminada cuando pierde su potabilidad para consumo diario o para su utilización en actividades domésticas, industriales o agrícolas.
Para evitar las consecuencias del uso del agua contaminada se han ideado mecanismos de control temprano de la contaminación. Existen normas que establecen los rangos permisibles de contaminación, que buscan asegurar que el agua que se utiliza no sea dañina. Cada país debe tener una institución que se encargue de dicho control. En Estados Unidos existen parámetros mencionados en la Farmacopea de los Estados Unidos(USP) que norman en relación a las especificaciones de todo tipoen el agua potable, en el área microbiológica se toman en cuenta niveles de alerta y niveles de acción.
A pesar del control y prevención que se persigue en muchos países, se reportan aguas contaminadas con coliformes lo que hace que la calidad del agua no sea la deseada, si bien muchos países tienen agua en grandes cantidades, el aumento poblacional, la contaminación de las industrias, el uso excesivo de agroquímicos, la falta de tratamiento de aguas negras y la erosión de suelos por la deforestación hacen que ese recurso sea escaso. En Guatemala cada año se producen 380 millones de metros cúbicos de aguas negras y de ellos, sólo 19 millones son tratados. El resto llega con toda su carga contaminante a los ríos y lagos.
La provisión de agua dulce está disminuyendo a nivel mundial, 1200 millones de habitantes no tienen acceso a una fuente de agua potable segura. Las enfermedades por aguas contaminadas matan más de 4 millones de niños al año y 20% de todas las especies acuáticas de agua fresca están extintas o en peligro de desaparecer.
PURIFICACION DEL
AGUA
La filtración es el proceso de separar un sólido del líquido en el que está suspendido al hacerlos pasar a través de un medio poroso (filtro) que retiene al sólido y por el cual el líquido puede pasar fácilmente.
Se emplea para obtener una mayor clarificación, generalmente se aplica después de la sedimentación para eliminar las sustancias que no salieron del agua durante su decantación.



El agua es el compuesto químico más abundante del planeta y resulta indispensable para el desarrollo de la vida. Está formado por un átomo de oxígeno y dos de hidrógeno, y su fórmula química es H2O. En la naturaleza se encuentra en estado sólido, líquido o gaseoso.
La contaminación del agua es el grado de impurificación, que puede originar efectos adversos a la salud de un número representativo de personas durante períodos previsibles de tiempo.
Se considera que el agua está contaminada, cuando ya no puede utilizarse para el uso que se le iba a dar, en su estado natural o cuando se ven alteradas sus propiedades químicas, físicas, biológicas y/o su composición. En líneas generales, el agua está contaminada cuando pierde su potabilidad para consumo diario o para su utilización en actividades domésticas, industriales o agrícolas.
Para evitar las consecuencias del uso del agua contaminada se han ideado mecanismos de control temprano de la contaminación. Existen normas que establecen los rangos permisibles de contaminación, que buscan asegurar que el agua que se utiliza no sea dañina. Cada país debe tener una institución que se encargue de dicho control. En Estados Unidos existen parámetros mencionados en la Farmacopea de los Estados Unidos(USP) que norman en relación a las especificaciones de todo tipoen el agua potable, en el área microbiológica se toman en cuenta niveles de alerta y niveles de acción.
A pesar del control y prevención que se persigue en muchos países, se reportan aguas contaminadas con coliformes lo que hace que la calidad del agua no sea la deseada, si bien muchos países tienen agua en grandes cantidades, el aumento poblacional, la contaminación de las industrias, el uso excesivo de agroquímicos, la falta de tratamiento de aguas negras y la erosión de suelos por la deforestación hacen que ese recurso sea escaso. En Guatemala cada año se producen 380 millones de metros cúbicos de aguas negras y de ellos, sólo 19 millones son tratados. El resto llega con toda su carga contaminante a los ríos y lagos.
La provisión de agua dulce está disminuyendo a nivel mundial, 1200 millones de habitantes no tienen acceso a una fuente de agua potable segura. Las enfermedades por aguas contaminadas matan más de 4 millones de niños al año y 20% de todas las especies acuáticas de agua fresca están extintas o en peligro de desaparecer.
PURIFICACION DEL
AGUA
La filtración es el proceso de separar un sólido del líquido en el que está suspendido al hacerlos pasar a través de un medio poroso (filtro) que retiene al sólido y por el cual el líquido puede pasar fácilmente.
Se emplea para obtener una mayor clarificación, generalmente se aplica después de la sedimentación para eliminar las sustancias que no salieron del agua durante su decantación.
INDAGACION BIBLIOGRAFICA. ELECTROLISIS DEL AGUA.
La Electrólisis del agua es la descomposición de agua (H2O) en gas de oxígeno (O2) e hidrógeno (H2) por medio de a una corriente eléctrica a través del agua. Este proceso electrolítico es raramente usado en aplicaciones industriales debido a que el hidrógeno puede ser producido más afortáblemente por medio de combustibles fósiles.
Una fuente de poder eléctrica es conectada a dos electrodos, o dos platos (típicamente hechos de algún metal inerte como el platino o acero inoxidable), los cuales son puestos en el agua. En una celda propiamente diseñada, el hidrógeno aparecerá en el cátodo (el electrodo negativamente cargado, donde los electrones son bombeados al agua), y oxigeno aparecerá en el ánodo (el electrodo positivamente cargado). La cantidad de hidrógeno generado es el doble que la de oxigeno, y ambas son proporcionales al total de carga eléctrica que fue enviada por el agua. Sin embargo, en varias celdas las reacciones del lado competidor dominan, resultando en diferentes productos.
La electrolisis de agua pura requiere una gran cantidad de energía extra en forma de sobrepotencial para romper varias barreras de activación. Sin esa energía extra la electrólisis de agua pura ocurre muy lentamente si es que logra suceder. Esto es en parte debido a la limitada autoionización del agua. El agua pura tiene una conductividad eléctrica alrededor de una millonésima parte de la del agua de mar. Varias celdas electrolíticas pueden no tener los electrocatalizadores requeridos. La eficacia de la electrólisis aumenta con la adición de un electrolito (como la sal, un ácido o una base) y el uso de electrocatalizadores.


Una fuente de poder eléctrica es conectada a dos electrodos, o dos platos (típicamente hechos de algún metal inerte como el platino o acero inoxidable), los cuales son puestos en el agua. En una celda propiamente diseñada, el hidrógeno aparecerá en el cátodo (el electrodo negativamente cargado, donde los electrones son bombeados al agua), y oxigeno aparecerá en el ánodo (el electrodo positivamente cargado). La cantidad de hidrógeno generado es el doble que la de oxigeno, y ambas son proporcionales al total de carga eléctrica que fue enviada por el agua. Sin embargo, en varias celdas las reacciones del lado competidor dominan, resultando en diferentes productos.
La electrolisis de agua pura requiere una gran cantidad de energía extra en forma de sobrepotencial para romper varias barreras de activación. Sin esa energía extra la electrólisis de agua pura ocurre muy lentamente si es que logra suceder. Esto es en parte debido a la limitada autoionización del agua. El agua pura tiene una conductividad eléctrica alrededor de una millonésima parte de la del agua de mar. Varias celdas electrolíticas pueden no tener los electrocatalizadores requeridos. La eficacia de la electrólisis aumenta con la adición de un electrolito (como la sal, un ácido o una base) y el uso de electrocatalizadores.
INDAGACION BIBLIOGRAFICA. SINTESIS DEL AGUA.
Se coloca el ácido clorhídrico junto con unos fragmentos de aluminio en el matraz Erlenmeyer y se tapa, el hidrógeno se recolecta en el globo que esta sujeto a una pipeta mediante una liga.
OBTENCIÓN DE AGUA POR LA REACCIÓN ENTRE EL HIDRÓGENO CONTENIDO EN EL GLOBO Y EL OXÍGENO DEL AIRE “
(Para que esta reacción ocurra necesita la aplicación de una chispa o flama, por ello el globo es acercado a un mechero de Bunsen encendido, la reacción es altamente exotérmica por lo que se debe hacer a cierta distancia. A continuación se presenta el momento en que ocurre la reacción, el agua queda suspendida en el aire en forma de vapor)
OBTENCIÓN DE AGUA POR LA REACCIÓN ENTRE EL HIDRÓGENO CONTENIDO EN EL GLOBO Y EL OXÍGENO DEL AIRE “
(Para que esta reacción ocurra necesita la aplicación de una chispa o flama, por ello el globo es acercado a un mechero de Bunsen encendido, la reacción es altamente exotérmica por lo que se debe hacer a cierta distancia. A continuación se presenta el momento en que ocurre la reacción, el agua queda suspendida en el aire en forma de vapor)
INDAGACION BIBLIOGRAFICA. MODELOS FISICOS
Un modelo físico puede referirse a una construcción teórica o a un montaje con objetos reales que trata de reproducir el comportamiento de algunos aspectos de un sistema físico o mecánico más complejo. El término aparece con diferentes acepciones en el ámbito de la física o en el ámbito de la ingeniería.
Se dice que una determinada teoría física es un modelo o un modelo físico teórico cuando su dinámica interna (las leyes básicas que vienen determinadas por el hamiltoniano) no son conocidas realmente. O son conocidas pero, si lo que se busca es estudiar exclusivamente algunos detalles particulares de un sistema complejo, puede resultar rentable (técnicamente) emplear otro tipo de dinámica (ficticia) que hace que el comportamiento en estudio del sistema completo sea aproximadamente igual que el que tendría con la dinámica más complicada.
Estos modelos se aplican en todas las áreas de la física (meteorología, termodinámica, física nuclear, materiales, etc.) excepto en física teórica. Como cualquier teoría física, un modelo de este tipo, reduciendo el comportamiento observado a hechos fundamentales más básicos, ayuda a explicar y predecir el comportamiento de un sistema físico bajo circunstancias diversas. Sin embargo, al no estar basado en una descripción fundamentalmente correcta, se espera que el modelo falle fuera de su campo de aplicación.
REACCIONES QUIMICAS

Una reacción química o cambio químico es todo proceso químico en el cual dos o más sustancias (llamadas reactantes), por efecto de un factor energético, se transforman en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
A la representación simbólica de las reacciones se les llama ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
Los tipos de reacciones inorgánicas son: Ácido-base (Neutralización), combustión, solubilización, reacciones redox y precipitación.
Desde un punto de vista de la física se pueden postular dos grandes modelos para las reacciones químicas: reacciones ácido-base (sin cambios en los estados de oxidación) y reacciones Redox (con cambios en los estados de oxidación).
INDAGACION BIBLIOGRAFICA: PROPIEDADES FISICAS DEL AGUA.
1) Estado físico: sólida, liquida y gaseosa
2) Color: incolora
3) Sabor: insípida
4) Olor: inodoro
5) Densidad: 1 g./c.c. a 4°C
6) Punto de congelación: 0°C
7) Punto de ebullición: 100°C
8) Presión critica: 217,5 atm.
9) Temperatura critica: 374°C
2) Color: incolora
3) Sabor: insípida
4) Olor: inodoro
5) Densidad: 1 g./c.c. a 4°C
6) Punto de congelación: 0°C
7) Punto de ebullición: 100°C
8) Presión critica: 217,5 atm.
9) Temperatura critica: 374°C
El agua químicamente pura es un liquido inodoro e insípido; incoloro y transparente en capas de poco espesor, toma color azul cuando se mira a través de espesores de seis y ocho metros, porque absorbe las radiaciones rojas. Sus constantes físicas sirvieron para marcar los puntos de referencia de la escala termométrica Centígrada. A la presión atmosférica de 760 milímetros el agua hierve a temperatura de 100°C y el punto de ebullición se eleva a 374°, que es la temperatura critica a que corresponde la presión de 217,5 atmósferas; en todo caso el calor de vaporización del agua asciende a 539 calorías/gramo a 100°.
Mientras que el hielo funde en cuanto se calienta por encima de su punto de fusión, el agua liquida se mantiene sin solidificarse algunos grados por debajo de la temperatura de cristalización (agua subenfriada) y puede conservarse liquida a –20° en tubos capilares o en condiciones extraordinarias de reposo. La solidificación del agua va acompañada de desprendimiento de 79,4 calorías por cada gramo de agua que se solidifica. Cristaliza en el sistema hexagonal y adopta formas diferentes, según las condiciones de cristalización.
A consecuencia de su elevado calor especifico y de la gran cantidad de calor que pone en juego cuando cambia su estado, el agua obra de excelente regulador de temperatura en la superficie de la Tierra y más en las regiones marinas.
El agua se comporta anormalmente; su presión de vapor crece con rapidez a medida que la temperatura se eleva y su volumenofrece la particularidad de ser mínimo a la de 4°. A dicha temperatura la densidad del agua es máxima, y se ha tomado por unidad . A partir de 4° no sólo se dilata cuando la temperatura se eleva,. sino también cuando se enfría hasta 0°: a esta temperatura su densidad es 0,99980 y al congelarse desciende bruscamente hacia 0,9168, que es la densidad del hielo a 0°, lo que significa que en la cristalización su volumen aumenta en un 9 por 100.
Las propiedades físicas del agua se atribuyen principalmente a los enlaces por puente de hidrógeno, los cuales se presentan en mayor número en el agua sólida, en la red cristalina cada átomo de la molécula de agua está rodeado tetraédricamente por cuatro átomos de hidrógeno de otras tantas moléculas de agua y así sucesivamente es como se conforma su estructura. Cuando el agua sólida (hielo) se funde la estructura tetraédrica se destruye y la densidad del agua líquida es mayor que la del agua sólida debido a que sus moléculas quedan más cerca entre sí, pero sigue habiendo enlaces por puente de hidrógeno entre las moléculas del agua líquida. Cuando se calienta agua sólida, que se encuentra por debajo de la temperatura de fusión, a medida que se incrementa la temperatura por encima de la temperatura de fusión se debilita el enlace por puente de hidrógeno y la densidad aumenta más hasta llegar a un valormáximo a la temperatura de 3.98ºC y una presión de una atmósfera. A temperaturas mayores de 3.98 ºC la densidad del agua líquida disminuye con el aumento de la temperatura de la misma manera que ocurre con los otros líquidos.
Suscribirse a:
Entradas (Atom)